-
Gyógyszerek
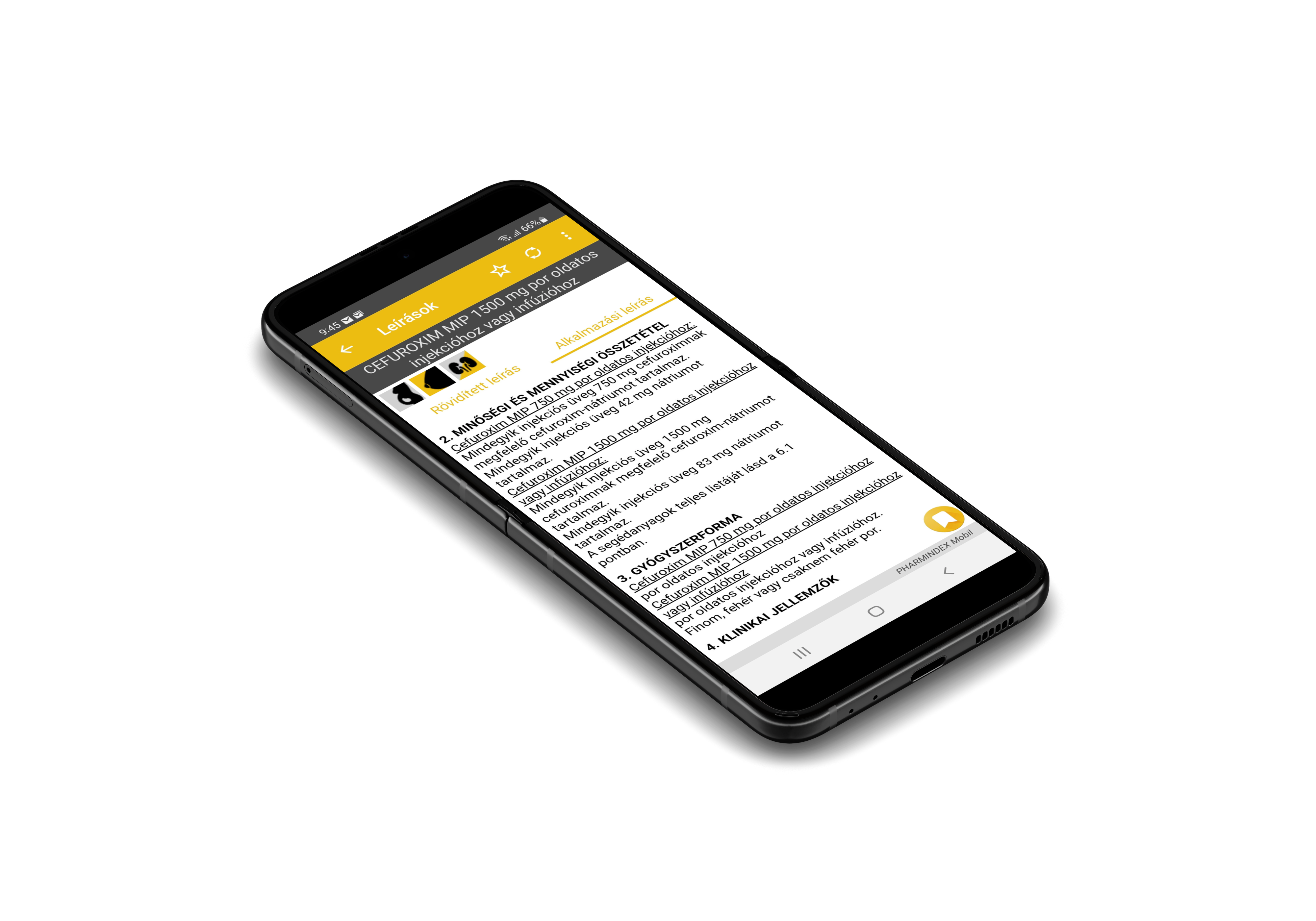
Gyógyszerkereső Hatóanyag kereső Helyettesíthetőség kereső ATC kereső BNO - Indikáció kereső BNO - Eü. jogcím kereső Gyártó kereső Interakció vizsgálat Gyógyszertörzs változás Laktóztartalmú gyógyszerek Patikán kívül is kapható termékek Fokozott felügyelet alatt álló gyógyszerek Termékhiány kereső Tételes elszámolás
- Adattárak
- Terápiás irányelvek
- Hírek, cikkek
- Rovatok