Új gyógyszercsoport első tagja: tolvaptán
Új farmakoterápiás csoport alakult az ATC-ban: C03XA alatt (vazopresszin antagonisták néven.) E csoport első tagjának forgalomba hozatali engedélykérelmét az EMA, az Európai Gyógyszerügynökség jóváhagyólag elfogadta.
A kérdéses hatóanyag a tolvaptán. Farmakológiai szempontból szelektív vazopresszin V2-receptor antagonista, amely a természetes arginin-vazopresszinnél nagyobb V2-receptor affinitással rendelkezik. Oralis alkalmazást követően a 15-60 mg dózis a vizeletkiválasztás fokozódását okozza, amely emelkedett aquaresist, csökkent vizelet-ozmolalitást és emelkedett se-Na koncentrációt eredményez. A Na és K vizelettel történő kiválasztását a tolvaptán nem befolyásolja jelentős mértékben. Metabolitjainak emberben, klinikai koncentrációban nincsen jelentős farmakológiai hatása.
Samsca 15 mg tabletta*
Minőségi és mennyiségi összetétel: 15 mg tolvaptán tablettánként.
Segédanyagok: Megközelítőleg 37 mg laktóz-monohidrát tablettánként
Terápiás javallatok
Inadekvát antidiuretikus hormon szekréciós szindróma (SIADH) következteében kialakuló hyponatraemiás felnőtt betegek kezelése.
Adagolás
A tolvaptán-kezelést 1x15 mg/nap dózissal kell kezdeni. A dózis tolerálhatóságtól függően 1x60 mg/nap-ra emelhető a kívánt Na-szint eléréséhez. A dózisbeállítás során ellenőrizni kell a se-Na szintet és a folyadékstatust.
Alkalmazás vesekárosodásban
Alkalmazása anuriás betegeken ellenjavallt. Súlyos veseelégtelenségben nem vizsgálták. Enyhe-közepes vesekárosodás esetén a dózismódosítás nem szükséges.
Ellenjavallat
• A készítmény hatóanyagával vagy bármely segédanyagával szembeni túlérzékenység
• Anuria
• Volumen depléció
• Hypovolaemiás hyponatraemia
• Hypernatraemia
• A szomjúság érzékelésére képtelen betegek
• Terhesség, szoptatás
Néhány fontosabb figyelmeztetés
Dehydratio
A tolvaptánt szedő betegeknél monitorozni kell a volumenstátuszt, mert a tolvaptán
-kezelés súlyos dehydratiót okozhat, ami a veseelégtelenség egyik rizikófaktora. Ha nyilvánvalóan dehydratio alakul ki, tegye meg a megfelelő intézkedéseket, így szükség lehet többek között a tolvaptán alkalmazásának abbahagyására vagy az adag csökkentésére és a folyadékbevitel növelésére.
Húgyúti obstrukció
Biztosítani kell a vizeletelvezetést. Részleges húgyúti obstrukcióban szenvedő betegeknél, például prosztata hypertrophiában vagy vizeletürítési rendellenességben szenvedő betegeknél, növekszik az akut retenció kialakulásának kockázata
Folyadék- és elektrolit-egyensúly
A folyadék- és elektrolitstátuszt minden betegnél figyelemmel kell kísérni, különösen a vese- és májkárosodásban szenvedő betegeknél. A tolvaptán alkalmazása a szérum nátriumszint túlságosan gyors emelkedését okozhatja (?12 mmol/l 24 óra alatt, kérjük, lásd alább). Ezért a szérum nátriumszint ellenőrzését a kezelés megkezdése után legfeljebb 4-6 órával minden betegnél meg kell kezdeni. Az első 1-2 napban és a tolvaptán dózis stabilizálódásáig a szérum nátrium- és folyadékstátuszt legalább 6 óránként monitorozni kell.
A szérum nátriumszint túlságosan gyors korrekciója
A nagyon alacsony kiindulási szérum nátriumkoncentrációval rendelkező betegeknél nagyobb lehet a szérum nátriumszint túlságosan gyors korrekciójának a kockázata.
A hyponatraemia túlságosan gyors korrekciója (? 12 mmol/l-es növekedés 24 óra alatt ) ozmotikus demyelinisatiót okozhat, amely dysarthriát, mutismust, dysphagiát, letargiát, affektív elváltozásokat, spasticus quadriparesist, görcsrohamokat, kómát vagy halált eredményez. Ezért a kezelés megkezdését követően a betegeknél a szérum nátriumszintet és a folyadék státuszt szorosan ellenőrizni kell (lásd fent).
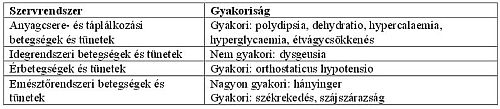
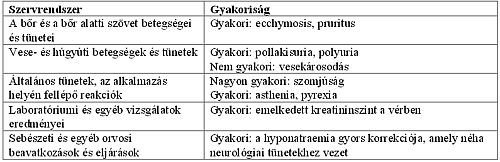
Mellékhatások
* A készítmény Magyarországon pillanatnyilag még nincs forgalomban.
További információ:
http://www.ema.europa.eu/docs/hu_HU/document_library/EPAR_-_Product_Information/human/000980/WC500048716.pdf
Szponzorált tartalom